Epigenética e Memória Celular
Marcelo Fantappié
A epigenética é definida como modificações do genoma que são herdadas pelas próximas gerações, mas que não alteram a sequência do DNA. Por muitos anos, considerou-se que os genes eram os únicos responsáveis por passar as características biológicas de uma geração à outra. Entretanto, esse conceito tem mudado e hoje os cientistas sabem que variações não-genéticas (ou epigenéticas) adquiridas durante a vida de um organismo podem frequentemente serem passadas aos seus descendentes. A herança epigenética depende de pequenas mudanças químicas no DNA e em proteínas que envolvem o DNA. Existem evidências científicas mostrando que hábitos da vida e o ambiente social em que uma pessoa está inserida podem modificar o funcionamento de seus genes.
O termo “epigenética” tem origem do grego, onde “epi” significa “acima, perto, a seguir”, e estuda as mudanças nas funções dos genes, sem alterar as sequências de bases (adenina, guanina, citosina e timina) da molécula de DNA (ácido desoxirribonucleico). As modificações epigenéticas podem ser herdadas no momento da divisão celular (mitose) e irão ter um profundo efeito na biologia do organismo, definindo diferentes fenótipos (i.e. morfologia, desenvolvimento, comportamento etc).
A epigenética tem seu efeito biológico a partir de mudanças químicas que podem ocorrer na molécula de DNA e em proteínas chamadas de histonas. Antes de abordarmos efetivamente o papel da epigenética na memória da célula, precisamos entender como a célula funciona.
A partir do momento em que um óvulo é fertilizado por um espermatozoide, essa nova célula (agora denominada de ovo) dará origem a um conjunto de células que irão originar o embrião. A formação do embrião depende da captação de sinais pelas células, sinais estes que podem vir de dentro das próprias células, de células vizinhas (incluindo as células da mãe) e do meio externo (do ambiente). Os sinais recebidos pelas células irão determinar não somente a morfologia e fisiologia do futuro embrião e indivíduo, mas também o seu comportamento. Nesse sentido, as células respondem a nutrientes e hormônios, mas também a sinais físicos, como calor e frio, e comportamentais, como estresse e carinho. Para que todos esses sinais tenham reflexos na molécula de DNA sob a forma de modificações epigenéticas, eles precisam alcançar um compartimento crucial da célula, o núcleo.
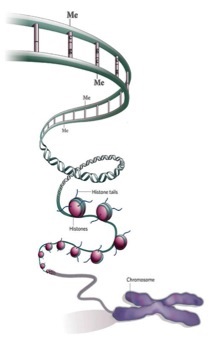
O núcleo é responsável por abrigar o DNA, entre outras moléculas (i.e. proteínas e RNA). Entretanto, sabemos que a molécula de DNA é infinitamente maior do que o próprio núcleo; por exemplo, o DNA humano, se esticado, teria um comprimento de cerca de 1 metro e meio; o núcleo de uma célula humana, mede cerca de 5 micrometros (5 x 10-6 m). Como isso é possível? O DNA é capaz de caber dentro do núcleo graças à ação de proteínas nucleares denominadas de histonas. As histonas se especializaram para empacotar a molécula de DNA numa estrutura chamada de nucleossomos, que assumem conformações similares a de um carretel de linha. Fazendo uma analogia, imaginem o carretel sendo as histonas, e a linha sendo a molécula de DNA. Se agora imaginarmos que o DNA (a linha do carretel) é composto pelos genes, e que muitos dos genes precisam ser expressos (ou seja, eles precisam decodificar suas sequências na forma de proteínas, que efetivamente são as moléculas que fazem as células funcionarem), se o DNA permanecesse totalmente enrolado, os genes não seriam capazes de serem expressos na forma de proteínas. É justamente nesse momento que entra a epigenética.
Para que os genes possam ser expressos, mediante a chegada dos sinais (mencionados acima), a molécula de DNA precisa ser parcialmente desempacotada, para que os genes fiquem acessíveis à ação de proteínas (os fatores de transcrição, que efetivamente disparam a ativação dos genes). Entretanto, diferentes genes são expressos em diferentes momentos e, naturalmente, estão localizados em diferentes regiões da molécula de DNA (ou nos cromossomos). Nesse sentido, partes da molécula de DNA são constantemente desenroladas e enroladas (o que se conhece por “remodelamento dos cromossomos”, ou “da cromatina”). Um exemplo de controle da expressão gênica pode ser descrito pela ação dos hormônios sexuais; na fase da puberdade, uma alta concentração de testosterona (nos meninos) ou estrogênio (nas meninas) é lançada na corrente sanguínea e esse é o sinal para que genes relacionados ao desenvolvimento sexual (i.e. crescimento de pelos, dos seios, aumento da massa muscular etc), sejam ativados e expressos. No momento desta sinalização, regiões do DNA (ou cromossoma) onde esses genes estão localizados, precisam ser abertas, desempacotadas, remodeladas. Por outro lado, no momento em que a fase da puberdade passa e os níveis de hormônios caem drasticamente, muitos destes genes precisam ser desativados e, agora, as mesmas regiões do DNA precisam ser fechadas, reempacotadas, para que esses mesmos genes não mais sejam ativados.
Esse constante remodelamento do DNA se dá justamente por mudanças epigenéticas ou seja, mudanças químicas que ocorrem tanto na molécula de DNA (a linha do carretel), como nas proteínas histonas (o próprio carretel). No DNA, ocorre a metilação, que é a adição de um grupo metila (-CH3, ou seja, um átomo de carbono ligado a três átomos de hidrogênio) ao nucleotídeo citosina; nas histonas, pode ocorrer tanto a metilação como a acetilação (-COCH3) nos aminoácidos lisina e/ou arginina. As modificações no DNA ou nas histonas são realizadas por enzimas do tipo DNA metilases/desmetilases, histona metilases/desmetilases e histona acetilases/desacetilases. A metilação do DNA, que geralmente ocorre em regiões que controlam a expressão gênica (denominadas de promotores), está relacionada à repressão gênica, ou seja, genes que estão marcados (metilados) para não codificarem (ou produzirem) proteínas. Já a acetilação das histonas está geralmente relacionada à ativação gênica.
Desde os anos de 1865, quando Gregor Mendel anunciou as leis da hereditariedade, deduzidas a partir de seus experimentos com ervilhas, os genes têm sido considerados como a única forma pela qual as características biológicas podem ser transmitidas através de sucessivas gerações. Entretanto, hoje existem várias evidências moleculares da existência de uma herança não-genética. Esses estudos mostram que variações não-genéticas adquiridas durante a vida de um organismo podem frequentemente ser transmitidas para os descendentes; um fenômeno conhecido como herança epigenética.
Como aprendemos acima, a adição de um grupo metila a molécula de DNA leva ao silenciamento de diversos genes, tendo um profundo impacto sobre a forma e a função das células e organismos, sem alterar o DNA correspondente. A metilação, e consequentemente o silenciamento de genes num determinado período do ciclo ou do desenvolvimento celular ou em determinados tipos celulares faz parte da estratégia evolutiva que culminou com o bom funcionamento celular (conhecido por homeostase) e de um organismo sadio. Caso esse padrão de metilação do DNA seja alterado, por exemplo, por agentes químicos afetando a atividade das metilases, um novo padrão de metilação no DNA será instalado, ativando genes que deveriam permanecer silenciados, podendo ter efeitos significativos na vida (e na saúde) de um organismo. Esse novo padrão epigenético será passado para as gerações futuras, o que caracteriza uma “memória epigenética”.
A herança epigenética traz implicações profundas para o estudo da evolução e reforça os argumentos do naturalista do século XVIII, Jean Baptiste Lamarck que acreditava que a evolução era dirigida em parte pela herança de características adquiridas durante a vida. Seu exemplo clássico é a girafa. Os ancestrais das girafas argumentava Lamarck, forçaram seus pescoços para alcançar folhas mais altas nas árvores. Ao fazer esse esforço, seus pescoços tornaram-se ligeiramente maiores, uma característica que foi passada para seus descendentes. Geração após geração a espécie herdou pescoços ligeiramente maiores, e o resultado são as girafas que conhecemos hoje.
Mudanças no genoma são vagarosas, através de mutações randômicas (ao acaso) e para que um traço genético (ou fenótipo) se instale numa população, isso pode levar muito tempo. O epigenoma por outro lado, pode mudar rapidamente em resposta aos diversos sinais que a célula pode receber. Nesse sentido, através da herança epigenética um organismo pode ajustar a expressão gênica de acordo com o ambiente onde vive, sem mudanças no seu genoma. Por exemplo, experiências vividas pelos pais (dieta, maustratos, tratamento hormonal) podem ser transmitidas para as gerações futuras. Isso tem sido bem demonstrado em uma série de estudos onde famílias com grave escassez de alimentos na geração dos avós, filhos e netos têm maior risco de doenças cardiovasculares e diabetes. Outros estudos sugerem que as mães passem aos filhos os efeitos cognitivos durante a gestação, provavelmente liberando hormônios que fazem com que marcadores químicos epigenéticos (não dependentes dos genes) apareçam nos genes de seus filhos, regulando sua expressão depois do nascimento. Outro exemplo claro do papel da herança epigenética pode ser encontrado nos gêmeos idênticos; estudos mostram que durante a transição da infância para a vida adulta, os gêmeos passam a divergir significativamente em seus níveis de sintomas relacionados à ansiedade e à depressão. Como compartilham do mesmo background genético (exatamente a mesma sequência de bases em ambos os genomas) essa divergência só pode ser fruto das experiências individuais durante a vida (e das mudanças epigenéticas).
Passado a era do sequenciamento do genoma humano (publicado em 2004), o esforço atual tem sido depositado em cima do sequenciamento do epigenoma, ou seja, na identificação de todas as citosinas metiladas ao longo do genoma. O epigenoma na sua totalidade irá levar a um melhor entendimento de como a função do genoma é regulada na saúde e na doença, e também como a expressão genética é influenciada pela alimentação e pelo ambiente.
***
MARCELO FANTAPPIÉ, Ph.D., é Professor Associado da Universidade Federal do Rio de Janeiro e Pesquisador do Laboratório de Helmintologia e Entomologia Molecular do Instituto de Bioquímica Médica da UFRJ.
Todos os direitos reservados.